2025 最新!进口保健食品注册与备案全流程揭秘,企业必看!
根据中国现行法规,进口保健食品的注册与备案是两种不同的市场准入制度,其适用范围、申报流程及材料要求存在显著差异。以下是截至2025年的最新政策要点及操作指南:
一、注册与备案的核心区别
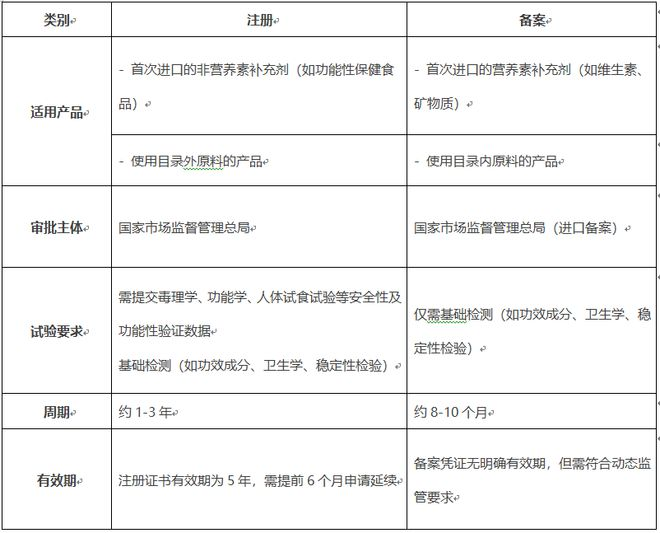
二、进口保健食品注册流程
1. 材料准备
o 基础材料:注册申请表、主体登记证明、研发报告(含配方、工艺、安全性论证)、产品标签样稿等。
o 额外材料:生产国(地区)出具的资质证明、上市销售证明、委托书。
2. 注册检验
o 需在指定检验机构完成毒理学、功能学、卫生学、稳定性等试验,并提供三批样品检测报告。
3. 技术审评与审批
o 国家市场监督管理总局组织专家对材料进行审评,可能涉及现场核查及动态抽样。通过后颁发注册证书(格式:国食健注J+年份+顺序号)。
三、进口保健食品备案流程
1. 备案条件
o 产品需使用《保健食品原料目录》内原料(如辅酶Q10、鱼油等),且功能宣称符合目录要求。
2. 材料提交
o 备案登记表、配方及工艺说明、检验报告(符合技术要求)、标签样稿等。
o 境外生产厂商需通过国家局申请备案账号,并提交资质证明文件(附加证明书简化认证)。
3. 备案公示
o 材料形式审查通过后,备案信息在国家市场监督管理总局官网公示,获得备案凭证(格式:食健备J+年份+00+顺序号)。
四、关键政策更新(2023-2025年)
1. 功能声称调整
o 新规范要求功能表述更严谨(如“增强免疫力”改为“有助于增强免疫力”),已注册产品需在5年过渡期内调整标签及宣称。
2. 检测标准细化
o 2024年发布多项国家标准(如葛根素、淫羊藿苷测定方法),提升检测精度。
五、常见风险与合规建议
1. 标签合规
o 必须标注“保健食品不是药物,不能代替药物治疗疾病”,并明确适宜人群及用量。
2. 广告限制
o 禁止宣称治疗功能(如“降血糖”“抗癌”),广告需经审查并标注批文号。
3. 动态监管
o 备案产品可能被抽检,发现问题需整改或撤销备案;注册产品需定期提交延续申请。
六、企业应对策略
• 选择注册或备案:根据原料和功能需求决策。创新产品建议注册以保护市场独占性;标准化产品选择备案降低成本。
• 委托专业机构:注册/备案材料复杂,可委托具备经验的第三方机构(如瑞欧科技)协助,缩短周期并规避合规风险。
总结:进口保健食品的注册与备案需严格遵循中国法规,企业应结合产品特性选择合适路径,并持续关注政策更新(如原料目录扩展、检测标准调整)。建议通过官方平台(如国家市场监督管理总局官网)或专业服务机构获取最新动态。
注:文章仅供参考,不作为任何依据使用,若您期望获取专业服务,请致电400-070-1617进行咨询。












